(原标题:北京,传来重磅利好!)
北京传来重磅利好!
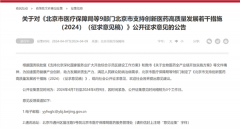
4月7日深夜,北京市医疗保障局突然发布“关于对《北京市医疗保障局等9部门北京市支持创新医药高质量发展若干措施(2024)(征求意见稿)》公开征求意见的公告”。此次征求意见稿公开征集时间仅3个工作日。临床研究第一条明确提出将临床试验启动整体用时压缩至28周内。
与此同时,广州、珠海两地也发布了促进鼓励生物医药产业高质量发展相关政策。
从政策导向来看,形成了一个广东给钱,北京给加速度的格局。分析人士认为,这应该不是巧合。在美国生物安全法持续发酵之际,这一利好也能起到较好的对冲作用。
北京重磅利好
4月7日深夜,北京医保局突然发布创新药重磅利好。公告称,根据国务院批复《支持北京深化国家服务业扩大开放综合示范区建设工作方案》和我市《关于生物医药全产业链开放实施方案》等文件精神,为加速医药健康产业创新,助力发展新质生产力,满足人民群众防病治病需求,北京市医疗保障局等9部门制定了《北京市支持创新医药高质量发展若干措施(2024)(征求意见稿)》,现向社会公开征求意见,欢迎社会各界提出意见建议。公开征集意见时间为:2024年4月7日至2024年4月9日,因时间紧急,公开征集意见时间缩短为3个工作日。
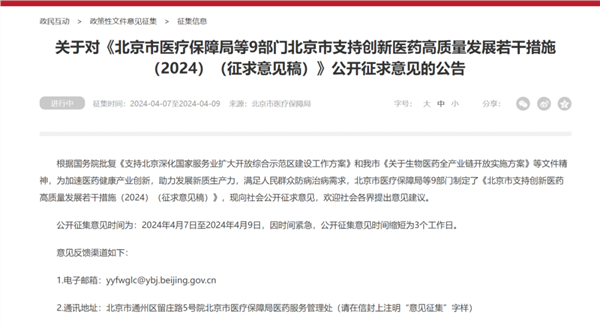
送审稿共八部分32条:包括:着力提升创新医药临床研究质效(4条)、助力加速创新药械审评审批(4条)、大力促进医药贸易便利化(3条)、加力促进创新医药临床应用(8条)、努力拓展创新医药支付渠道(3条)、鼓励医疗健康数据赋能创新(5条)、强化创新医药企业投融资支持(3条)和保障措施(2条)。在产品研发、临床试验、审评审批、生产制造、流通贸易、临床应用等环节,通过政策协同,支持创新医药发展;推动医疗健康数据赋能创新,丰富应用场景,依托人工智能、健康大模型等,支持医疗健康产业数字化、智能化升级;推动本市生物医药产业和保险金融业协同发展,完善创新药械配备使用和多元支付体系,切实减轻人民群众医疗费用负担,不断满足人民群众日益增长的健康需求。
值得注意的是,此次北京的政策明显起到了“加速包”的作用。文件显示,推动实施“药品补充申请审评时限从200日压缩至60日、药品临床试验审批时限从60日压缩至30日”的国家创新试点;将临床试验启动整体用时压缩至28周以内;建立对外交流平台,优化药品出口流程,2024年推动5个品种“走出去”;争取国家相关部门支持,前置评估、优化流程,建立临床急需进口药械审批绿色通道,2024年力争推动10个临床急需品种进口。
广东两地同频共振
除了北京之外,广州黄埔区和珠海也同时出台了类似的政策。
广州开发区管委会、广州市黄埔区人民政府昨日印发广州开发区(黄埔区)促进生物医药产业高质量发展办法的通知。对创新药、改良型新药和生物类似药,在国内临床试验研发费用投入1000万元以上的,根据其临床研发进度,分阶段最高按实际投入临床研发费用的40%给予资助:完成Ⅰ、Ⅱ、Ⅲ期临床试验的,经认定,分别给予最高1000万元、2000万元、3000万元扶持,单个企业每年最高资助1亿元。鼓励医疗机构提升新药临床试验能力,对符合国家药物临床试验质量管理规范(GCP)的临床试验机构,每新增1个GCP专业学科给予30万元扶持,单个机构每年最高150万元。对取得国家药监局(NMPA)药物临床批件的药物,每个批件最高资助50万元。对获得药品注册证书的药品(不同规格视为同一个品种),每个品种给予最高1000万元一次性资助。对已上市药品通过仿制药质量和疗效一致性评价或被列为参比制剂的(不同规格视为同一个品种),每个品种给予100万元资助。单个企业每年最高资助2000万元。
珠海市工业和信息化局亦发布《珠海市促进生物医药与健康产业高质量发展若干措施(征求意见稿)》。该意见稿同样是强化了资金扶持。对化学药品1-2类、生物制品(按药品管理的诊断试剂除外)、中药(中药创新药、中药改良型新药),根据研发各阶段成果给予奖励。对完成I、II、III期临床试验阶段(完成关键性临床试验可根据实际情况判定视为完成I、II或III期临床),分别给予最高300万元、500万元和1000万元一次性奖励。对获得药品注册证书并实现销售的,按药品注册分类标准给予最高1000万元奖励。对创新型高端制剂(包括纳米粒、微球、脂质体、控释、缓释剂型以及微针等创新剂型)单品种首个注册证书再给予100万元奖励。对创新药研发期间获得突破性疗法和附条件批准的,再给予100万元奖励。单个企业每年新药研发相关奖励最高不超过2000万元。

由此,三地针对创新药发布的重大利好形成了一个“广东给钱,北京加速”的格局。
影响多大?
那么,利好究竟会有多大呢?
首先,北京给了不少政策,广东给了不少钱,在这种示范之下,预计后续各地会陆续出台类似的政策利好。毕竟,创新药属于新质生产力范畴,这对整个板块来说是实实在在的利好;
其次,自1月美国《生物安全法案》被提出以来,国内创新药板块被打压得很惨。4月4日,Endpoints发表的一篇报道再次激起市场波澜。原文指出,美国生物安全法案(The Biosecure Act)所覆盖的企业名单可能会覆盖更多的中国CRO/CDMO企业。上述政策利好出台,能较好地对冲掉美国《生物安全法案》的冲击。
东吴证券认为,北京率先落地创新药全产业链支持政策,广州同步出台创新药支持政策通知,支持态度与网传文件基本一致,此前上海将生物医药纳入4个万亿元级产业集群之一,国家层面支持文件落地可以期待,创新药产业发展的政策束缚将全面解绑;北京起草说明文件提出推动生物医药产业和保险金融业协同发展,完善创新药械配备使用和多元支付体系,未来中国创新药商业化环境将焕然新生。